医疗器械不良事件监测和再评价制度是我国现行的医疗器械监管模式,并且是医疗器械生产、经营、使用过程中重要的监管环节。国家药监部门发布实施《医疗器械不良事件监测和再评价管理办法》,加强对医疗器械上市后风险的控制,取得良好效果,受到业界广泛关注。为贯彻落实法规要求,分析总结案例和实践经验,提出下一步工作要求,应业界要求,中国医疗器械行业协会定于2022年12月15日在北京举办医疗器械不良事件监测和再评价工作政策培训会,届时将邀请国家药监局医疗器械监督管理司、国家药监局药品评价中心(国家药品不良反应监测中心)专家进行深入、精准的培训和解读。欢迎医疗器械行业的同道积极参与,共同学习。现将有关事项通知如下:
一、会议时间及地点
会议时间:2022年12月15日,会期1天
会议形式:会议为线上培训
二、参会重要事项
(一)本次培训为线上培训形式,参会学员填报报名信息并缴费成功后即为报名成功。
(二)请各参会人员严格遵守防疫政策要求,在京人员非必要不聚集,京外人员非必要不来京。
三、培训内容
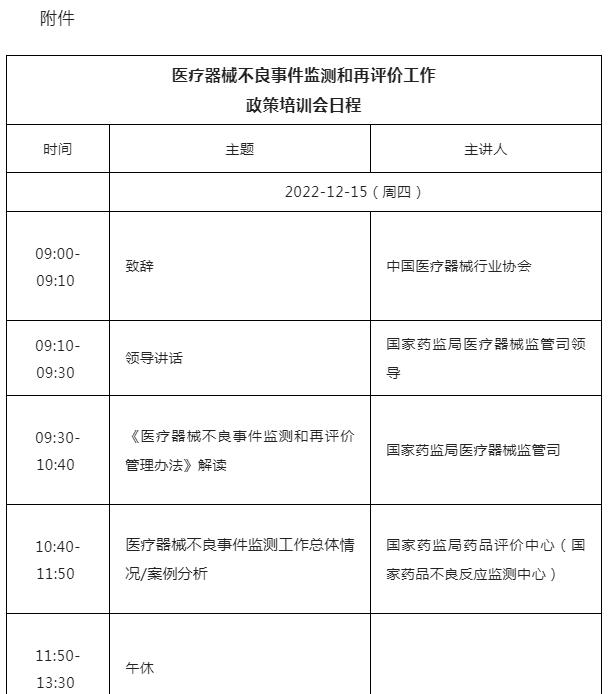
(一)《医疗器械不良事件监测和再评价管理办法》解读
(二) 医疗器械不良事件监测工作总体情况/案例分析
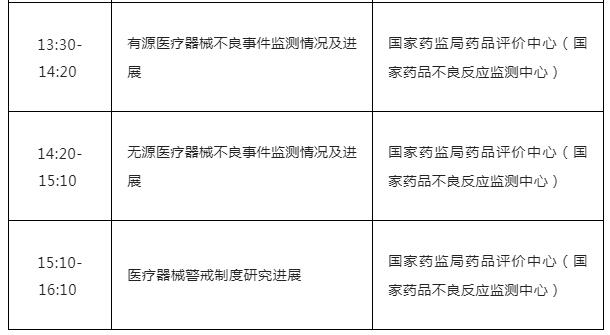
(三) 有源医疗器械不良事件监测情况及进展
(四) 无源医疗器械不良事件监测情况及进展
(五) 医疗器械警戒制度研究进展
四、科技新势力
联系人:
报名环节:
李老师13666107022
申老师13910500127
巫老师13709028919
卢老师13426398158
软件环节:
徐老师13810381871
E-mail:wuhuirong@imddoctors.com
五、参会须知
(一)缴费及参会办法
本次培训为线上培训形式,请各参会代表访问润智在线官网(网址:https://www.runzhi360.com/)参与培训,或者从官网下载最新版“润智在线”APP参与培训。
进入官网或APP,注册登录后,先完善单位、姓名、E-mail等报名信息,然后选择本次培训,缴费后即完成报名,会议发票可在培训结束后通过润智在线官网申请开具。
报名成功后通过润智在线官网或APP在线参加会议。
(二)会议费标准
中国医疗器械行业协会会员企业900元/人,非会员企业1300元/人。(会员单位在“个人中心”或“我的”-“我的发票”里完善开票单位信息后,即可享受会员价)
(三)培训承办单位
北京正则润智科技有限公司。
附件:培训日程
中国医疗器械行业协会
2022年11月29日
文章内容来源:网络
免责说明:本文由网友自由发布,如有侵权,请联系本网站进行删除